知識の宝庫! 目がテン! ライブラリー 皆さん、 マグネシウム ってご存知ですか? 昔、カメラのフラッシュに使われていたり、学校の実験でも使ったりしましたが、あんまり印象が無いですよね。 ところが、 携帯電話やパソコンなどの電化製品 や※1:4796g(実験前の二股試験管の質量) ※2:4765g(実験後の 〃 ) ※3:167ml (捕集気体の体積) ※1-※2:031g(捕集気体の質量) 以下は"考察"です。Atomic Weight of Magnesium(マグネシウムの原子量) 放出した水素ガスの量によって、マグネシウムの原子量を決定します。 / Balance Lab(精秤実験) 3種類の異なる秤の精度を調べます。 / Bond Lab(結合実験) イオンと共有結合の化学的挙動を調べます。 /

新基礎化学実験法の通販 谷洋介 西井祐二 布谷直義 宮崎裕司 山口和也 山田剛司 吉成信人 紙の本 Honto本の通販ストア
マグネシウム 原子量 実験
マグネシウム 原子量 実験- 元素(英:Element)および 同位体(英:Isotope)は、Minecraft における化学の本質的な部分として機能するブロックである。 1マグネシウム: マグネシウムの原子番号は12です。 原子量 マンガン: マンガンの原子量は約54 amuです。©₂₀₁₅日本化学会 原子量専門委員会 原 子 量 表 (₂₀₁₅) (元素の原子量は,質量数₁₂の炭素( 12c)を₁₂とし,これに対する相対値とする。




Amazon 元素標本 マグネシウム Mg 10mm角キューブ 刻印aタイプ 岩石 鉱物 おもちゃ
=マグネシウムの質量( )、 =マグネシウムの当量である またマグネシウムと反応した硫酸の濃度の変化を水酸化ナトリウムとの中和滴定によってマグネシウムの当量を計算することができる。マグネシウムと反応させていない硫酸を 溶液、マグネシウムと硫酸が反応したものを 溶液として、中和 例えば、1 molのマグネシウム (243g)からは、1 molの水素4 L (標準状態)が得られることになる。 実験では、水素を水上置換で気体として得て、その時の気圧 P 、水素の体積 V 、絶対温度 T 、気体定数 R から物質量 n (=m/M)が求まる。第37時 実習11 定比例の法則 17 9 11(月) 普通教室 はじめに 過去2回で学習した『マグネシウムの酸化』『銅の酸化』の理想的な実験結果を確認します。 2つのデータを比較することで、マグネシウムと銅の共通点と相違点を明らかにします。
ることを実験結果から見いだすことをねらいとしている。 この実験でマグネシウムを用いると,燃焼にともなっ て,熱や光を出すので生徒の興味・関心を高めるが,質量 の変化では誤差が生じる要因が多く,比例関係が見いだし にくい。マグネシウム摂取量不足による軽度のマグネシウム欠乏 が生じているとされている11)。日本国内における大規模 調査でも,4079歳の被験者におけるマグネシウム摂取 量は,25%タイル値で1485 mg/日であり12),日本人のマグネシウム(鎂、ラテン語 magnesium 英語発音 mæɡˈniːziəm )は、原子番号12の元素である。マグネシュームともいう。元素記号Mg。原子量。金属元素、第2族元素のひとつ。
化学変化と質量2 (発展) うすい塩酸にマグネシウムを入れて気体を発生させる実験を行った。 これについて問に答えよ。 ただし実験で使用したビーカーは全て同じ質量である。 実験 ビーカーの中にうすい塩酸を50cm 3 いれて質量を測ったら850gだったMgリボンの質量は、1cmで0.01gくらいです。 2cmほどなら0.02gくらい。 塩酸と反応させると、 Mg + 2HCl → MgCl 2 + H 2 Mgの原子量を24、標準状態の気体1モルの体積を22.4Lとし、 0.02gのMgから発生するH 2 は、化学反応式より 0.02÷24×22.4L≒18mL程度となります。 標準状態は0℃ですので、実験室の気温が25℃としても、mLほどです。 そんな量では、余程深い ただし,一度に使用するマグネシウムの量は 050 g 以下,酸化マグネシウムの量は 100 g 以下とする。また,塩酸(100 mol/L)の密度は 102 g/mL,実験での水溶液の 比熱は 418 J/( g・℃),水素,酸素,マグネシウム及び塩素の原子量はそれぞれ 10 0, 160,243,355 とする。
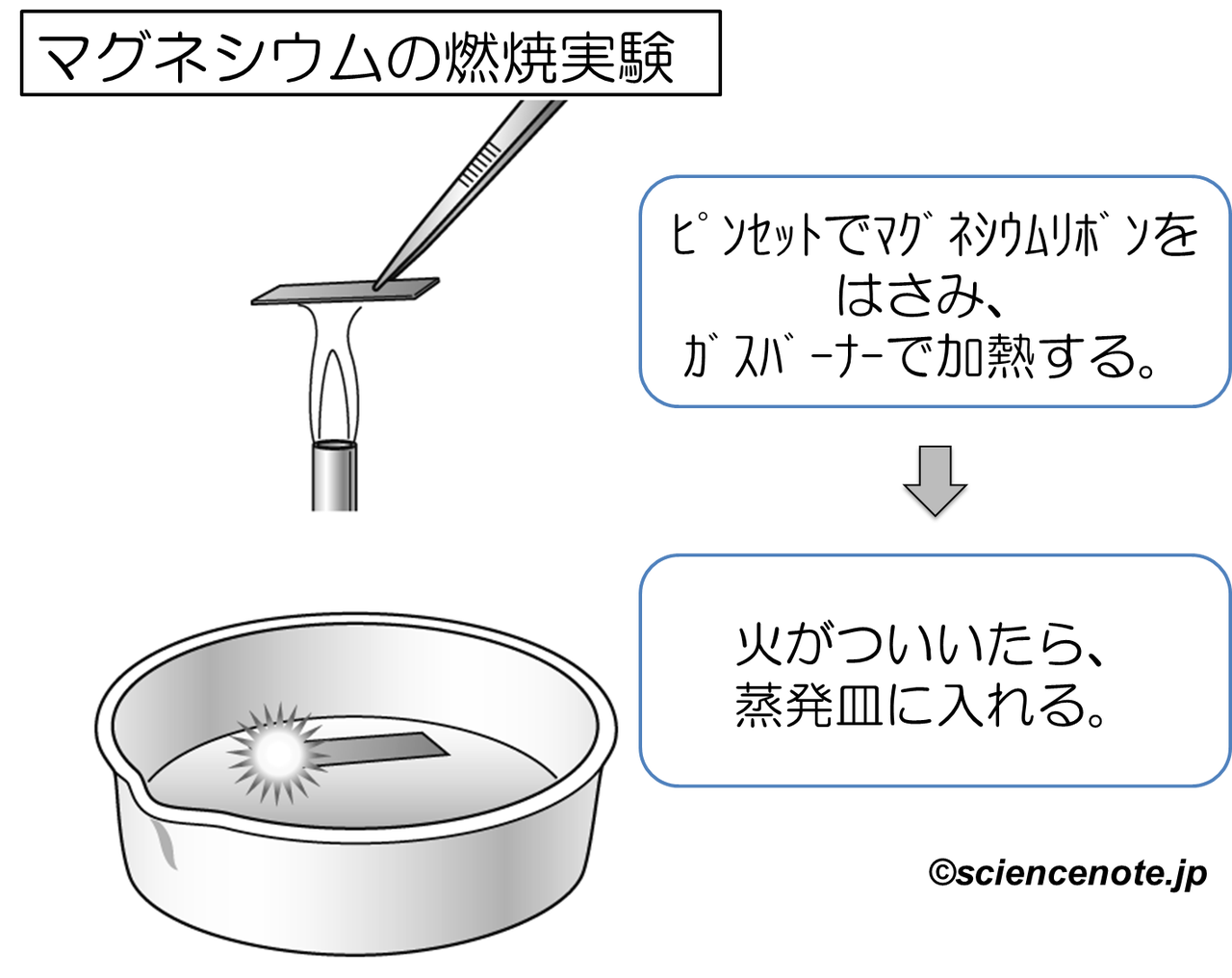



中2化学 マグネシウムの燃焼 Sciencenote Jp




この解き方分かりません 教えて下さい 3 の問題です Clear
Q1.ヘリウム原子4.2×10 23 個の物質量は何mol? ヘリウム原子の数を物質量の式の、「粒子の数」に当てはめ、 物質量=4.2×10 23 /(6.0×10 23実験場所 化学実験室 方法 (1)マグネシウムMgと塩酸HClが反応して,塩化マグネシウムMgCl2と水素H2ができる化学反応式を書いてください。 (2)捕集する水素の体積を13~18mLの範囲で、班で決1 マグネシウムの質量を変えて ¤040,060,080,100,1,140g ¥それぞれを 熱して質量をはかる。化合物の質量がそれ以上増えなくなったときの質量を記録 する。 2 銅についてもマグネシウムと同様に行う。 中学2年理科 化学変化と原子・分子



マグネシウムを使って水素を発生させる実験で 写真の真ん中の マ Yahoo 知恵袋




Pdf Electron Microprobe Analysis Of Mg Ge Alloy Examination Of The Mass Absorption Coefficient Of Ge For Mg Ka
原子吸光分光光度法によるマグネシウム,カ ルシウムの定量に関する基礎的条件の検討を行ない,こ れをスラッグ中のマグネシウム,カ ルシウムの定量に応用したマ グネシウムの測定条件は,波 長285 憩μ,hollow cathode lampの 電流値30mA,空 気圧11kg/cm2,ア セチレン圧048kg/cm2が 最 適で,カ ルシウムの測定条件は波長422mμ,hollow cathode lampの 電流値50mA, 空気圧11kg/製法 金属マグネシウムを燃焼させると生成する。 水酸化マグネシウムあるいは炭酸マグネシウムを加熱分解すると生成する 。 高温でホウ酸塩と酸化マグネシウムを融解したものを徐冷すると立方体の結晶が析出する 。 性質 融点 2800 °C (K)、沸点 3600 °C (K)、密 実際には、扱いやすい量で実験しています。 その結果をもとに計算して マグネシウム0024gの時の気体の体積(22ml)を求め、 さらにその結果から、水素1molの体積(22L)を計算しました。 しかし、本当は246Lになるはずなのですが 22Lになってしまったのです。
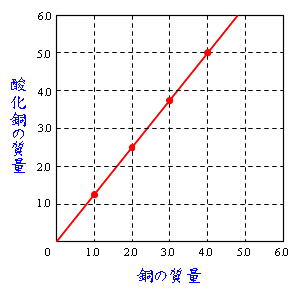



Science 化学変化と質量比 定比例の法則と原子量 分子量 働きアリ




中3化学変化です 2 の解説お願いします Clear
原子量・分子量と1 mol の質量 -19 ☆実験の内容自体が思い出せない。 ☆抽象的だった。 5 単分子膜を使ってアボガドロ数を求める -14 ☆計算がめんどうであった。 6 結晶の性質(1)イオン結晶の電気伝導性 -14 元素記号Mg、原子番号12番の元素。マグネシウムは海水や岩石、生体の中などにも多く含まれ、にがり(主成分は塩化マグネシウムMgCl 2 )や便秘薬(主成分は酸化マグネシウムMgO)にも含まれていることからも身近であろう。 血液に含まれる赤い成分ヘム鉄によく対比される、植物の緑色素的とした場合のMg,K,Ca 添加量は,検量線に 収まる範囲内とした. 5 比色法と原子吸光法・炎光法との比較 飼料72標品(Mgについては米ヌカを除く71標品) 中の比色法で測定した各ミネラル濃度結果は,既報 のMg,K,Ca の定量結果と比較した.




Pdf Wettability Of Molten Magnesium On Carbon And Aln



原子番号12番のマグネシウムには3種類の安定な同位体が存在しその割合はおよそ Yahoo 知恵袋
これを物質量で捉えなおすと、1molのマグネシウムと2 molの塩化水素が反応して、1 molの塩化マグネシウムと1 molの水素が発生することになる。原子間の 結合 が再構成されても、原子単位での質量に変化はない。実験結果を確認しましょう。 シクロヘキサンの蒸気の質量は,w1w2ですね。この質量が0.70g,蒸気の温度t が92.0℃,フラスコの容積v が242.0mL,大気圧p が1013hPaであったとしましょう。 さて,これらのデーターからシクロヘキサンの分子量をどのように求めたらよいのでしょうか。水素吸蔵マグネシウムにおけるnmr 実験 水素は地球上に最も豊富に存在する元素のひとつであり,その核であるプロトンの存在比もほぼ 100 %である.プロトンのスピンは 1/2 で,それに付随する磁気モーメントは自然存在比の多い核では最大の




マグネシウム Magnesium にがりの成分から軽量化合物材料まで Chem Station ケムステ




1g 1 80g Descubre Como Resolverlo En Qanda
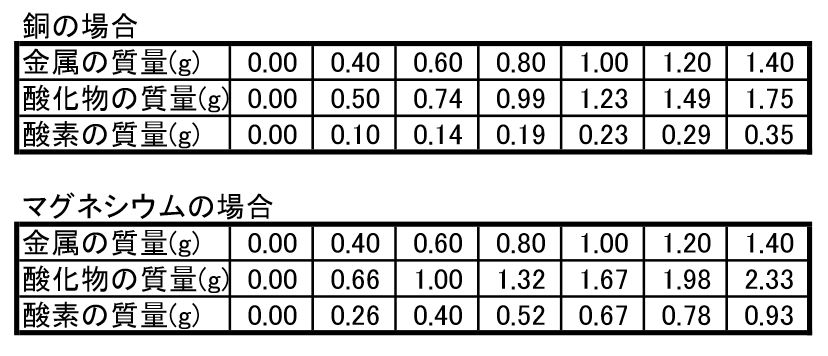
本時の題目 マグネシウムと銅の酸化実験の結果をもとに,原子量の比を推定する。 本時の目標 1.銅の酸化実験について,安全かつ適切に実験操作を行う。 2.銅の酸化実験の結果を正しく分析し,酸化銅中の銅と酸素の質量比を求める。(2) マグネシウムを熱したときにできる 物質の物質名を答えよ。 (3) この実験の化学変化を化学反応式で 表せ。 (4) この実験で,マグネシウムをステン レス皿全体にうすく広げて加熱する のはなぜか。©₂₀₁₆日本化学会 原子量専門委員会 原 子 量 表 (₂₀₁₆) (元素の原子量は,質量数₁₂の炭素( 12c)を₁₂とし,これに対する相対値とする。但し,この 12cは核および電子が基底状態にある結合してい ない中性原子を示す。
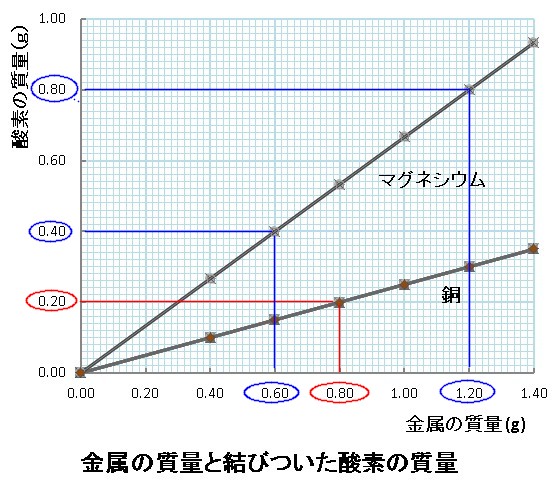



化学変化と物質の質量4 質量変化の規則性 後編 理科とか苦手で




マグネシウムと塩酸の反応についての問題 マグネシウムと塩酸の反応で 水 Okwave
実験1 マグネシウム粉末の質量を測定 し,ステンレス皿にのせた。次に, 図1の装置で十分に加熱した後, できた酸化マグネシウムの質量を 測定した。 実験2 マグネシウム粉末の質量を変え て,同じ実験を行った。図2は,マなるため Mg の原子量24とすると,0.Ol25×24=O.30 gに なる 。 ここで行う計算をみればわかるように,気体1mol の体 積を24L にすると,偶然Mgの 原子量が24であるため消 「金属を塩酸と反応させて気体を発生させる」という実 参加申し込みに際して、以下の4つの実験のうち、興味のある実験について第一希望および第二希望をお選び申し込みください。 1)マグネシウムの原子量を測る(中和滴定) 2)銅を電気めっきする(電解合成) 3)医薬品を合成する(有機合成)




マグネシウム Wikipedia



Koushien Jst Go Jp Koushien Tournament 11 Pdf Jikken1 Chemistry Question Pdf
4 マグネシウムと銅をそれぞれ加熱し,質量の変化を調べる実験を行い,できたものについて調べまし た。問1~問5に答えなさい。 実験1 ⑴ 電子天 てん 秤 びん でマグネシウムの粉曒02gをはかりとった。2.マグネシウムおよびその合金の特性 2.1 マグネシウム合金の添加元素とその特徴 マグネシウムは,原子番号12,原子量,密度174 g/cm3, 融点924 K,沸点1380 K で,軽い銀白色を示す。実用金属 元素の中では最も比重が小さい。基礎化学 INDEX へ戻る 原子 番号 元素 英語 記号 原子量 1 水素 Hydrogen H 1008 2 ヘリウム



Researchmap Jp Read Published Papers Attachment File Pdf




新編改訂化学基礎 ダイジェスト版
マグネシウムは原子番号12,原子量243 の広義のアルカリ土類金属である.マグネ シウムの密度は293K において174×10 3 kg/m 3 であり,代表的な軽量金属材料のアルミマ グネシウム原子の 原子量は24,酸素の原子量は16 であり , 簡単な整数比で表すと3;2となる。この値は実験 結果から得られたものと近い値を示してい る。 中学校では原子量は発展の扱い になるが,実験 うすい塩酸とマグネシウムを反応させると水素が発生します。 その際、塩酸やマグネシウムの容積も減りますか? 減って、しまいにはマグネシウムが消滅。 なんてこともありますか? / 適切な漁量の塩酸と反応させればマグネシウムはなくなりますよ。



化学反応における物質の量的関係を調べる実験で 塩酸とマグネシ Yahoo 知恵袋




上 マグネシウム 原子量 3466 マグネシウム 原子量 求め方
マンガンの原子量は約5493 amuです。 それとは別に、マンガンは、実験室規模の用途で必要とされる多くの化学種で有用です。 マグネシウム:マグネシウムの原子半径は約160 pm ただし、原子量はMg=24,標準状態での気体の体積を224Lとする。 Mg 2HCl → MgCl2 H2 (1) 1molのマグネシウムが反応する時、発生する水素の物質量は何molか。 (2) 48gのマグネシウムに十分な量の希塩酸を加えると標準状態で何Lの水素が発生するか。




実験式とは コトバンク




この問題はどの公式を使えばいいのでしょうか お願いします Clear




Amazon 元素標本 マグネシウム Mg 10mm角キューブ 刻印aタイプ 岩石 鉱物 おもちゃ




理科実験のページ 埼玉県立松山高等学校



Www Pu Toyama Ac Jp Data Uploads 16 09 E7 94 9f E7 Pdf
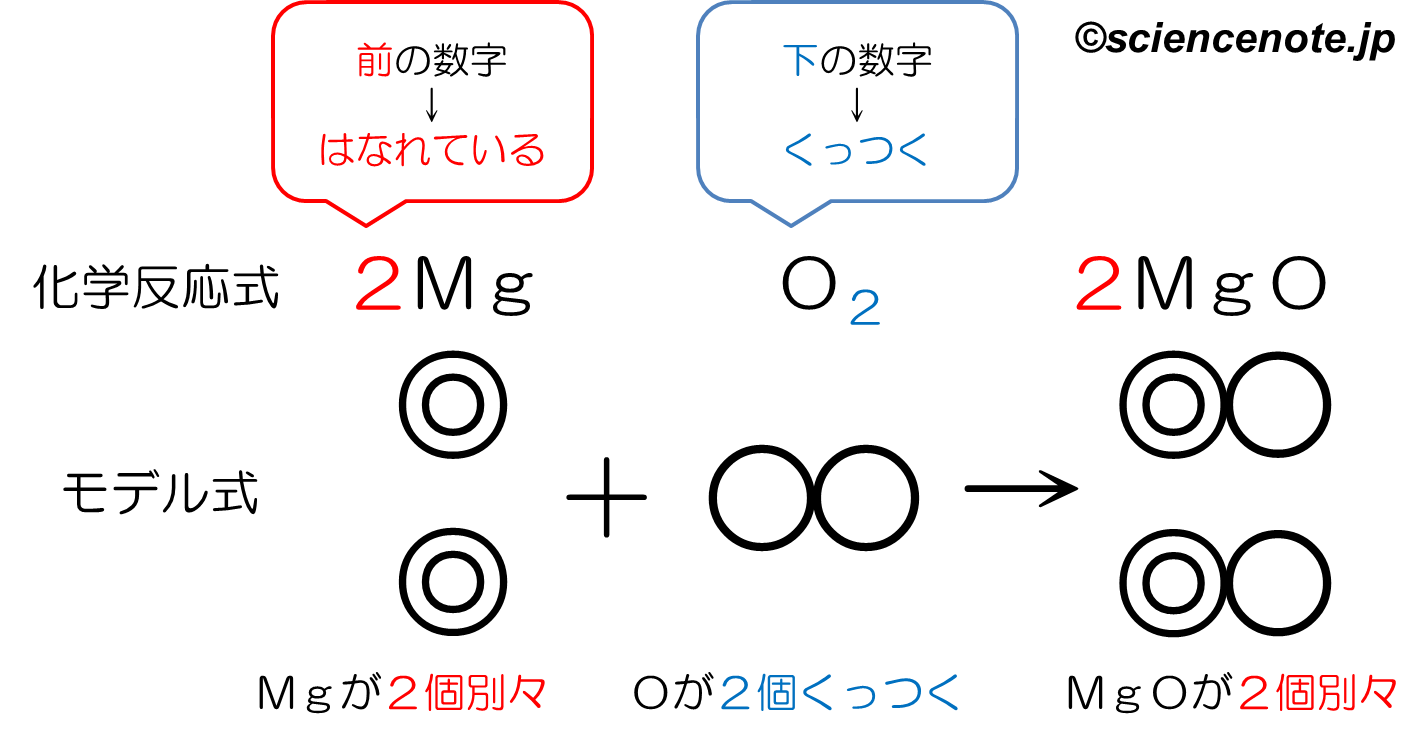



中2化学 マグネシウムの燃焼 Sciencenote Jp



Www Nakatani Foundation Jp Wp Content Uploads 16fed80a4e7da8418e94ec923f05b58e Pdf




新元素 119番元素 合成へ




実験5 紫外可視吸収スペクトル法 I I T I I 100 100 T I I Manualzz




マグネシウムと塩酸の反応についての問題 マグネシウムと塩酸の反応で 水 Okwave



亜鉛とは コトバンク




1g 1 80g Descubre Como Resolverlo En Qanda




原子量



福井工業大学 原 道寛 学籍番号 氏名 Ppt Download




マグネシウム Mg




化学変化と物質の質量4 質量変化の規則性 後編 理科とか苦手で




マグネシウム Mg



1




7 12 6 1 100g I 10g 1 Descubre Como Resolverlo En Qanda




この実験の 1 2 3 の書き方が全く分からないので教えてください Clear



Www Mext Go Jp Content 0428 Mxt Kouhou02 15 Pdf



福井工業大学 工学部 環境生命化学科 原 道寛 名列 氏名 Ppt Download




00 号 アルミ合金の溶湯中のマグネシウムの含有量を測定する法 Astamuse




問いの4番です 原子量を使わずに解く方法はありますか よろしくお願いします Clear




理科実験のページ 埼玉県立松山高等学校



化学変化と物質の質量4 質量変化の規則性 後編 理科とか苦手で



1
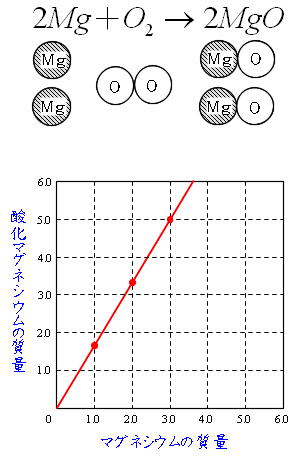



Science 化学変化と質量比 定比例の法則と原子量 分子量 働きアリ




改訂化学基礎 改訂化学 ダイジェスト版
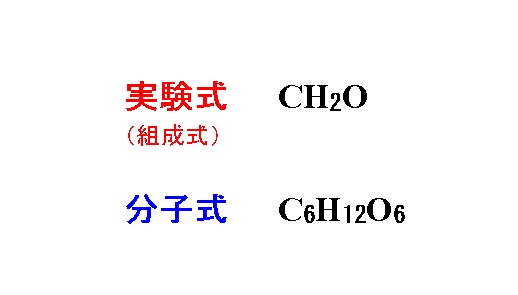



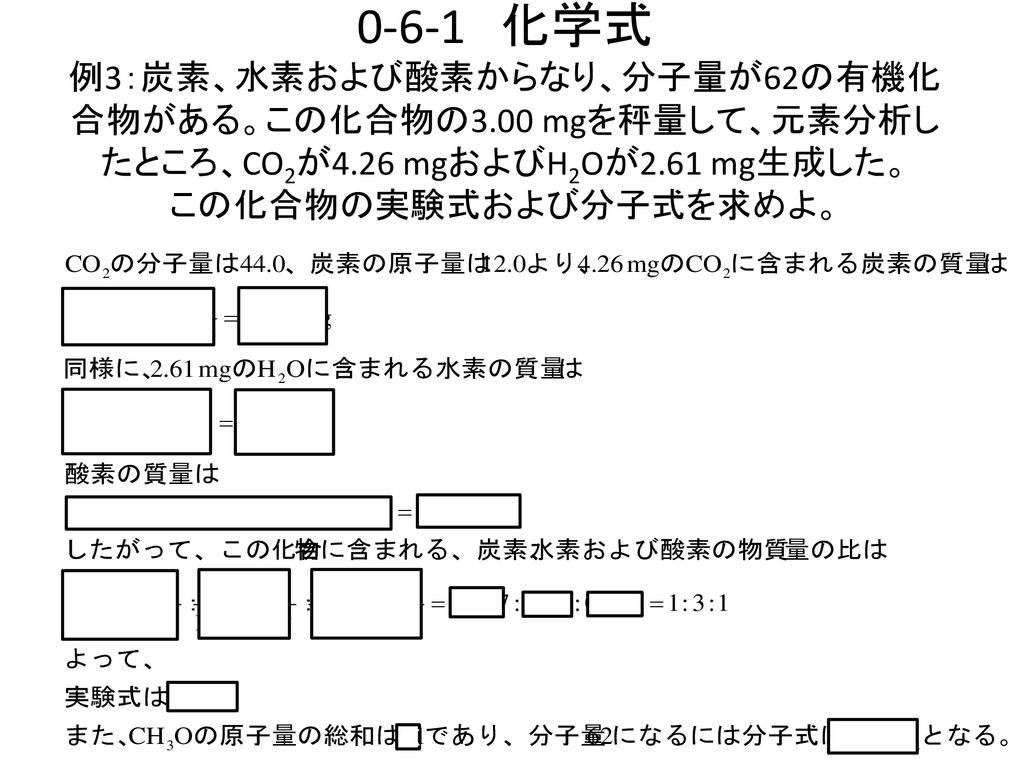
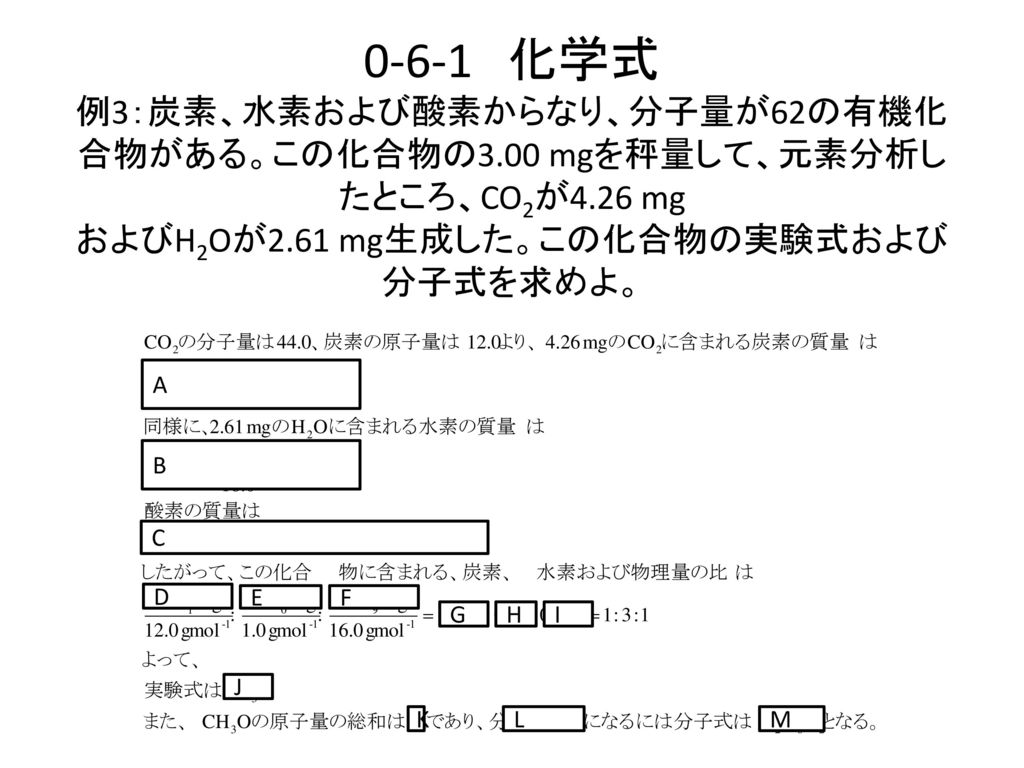
有機化合物の実験式 組成式 を求める計算と分子式の決定



理工系のための 化学実験 生物工学実験 東京電機大学 自然科学系列 編集 学術図書出版社 版元ドットコム
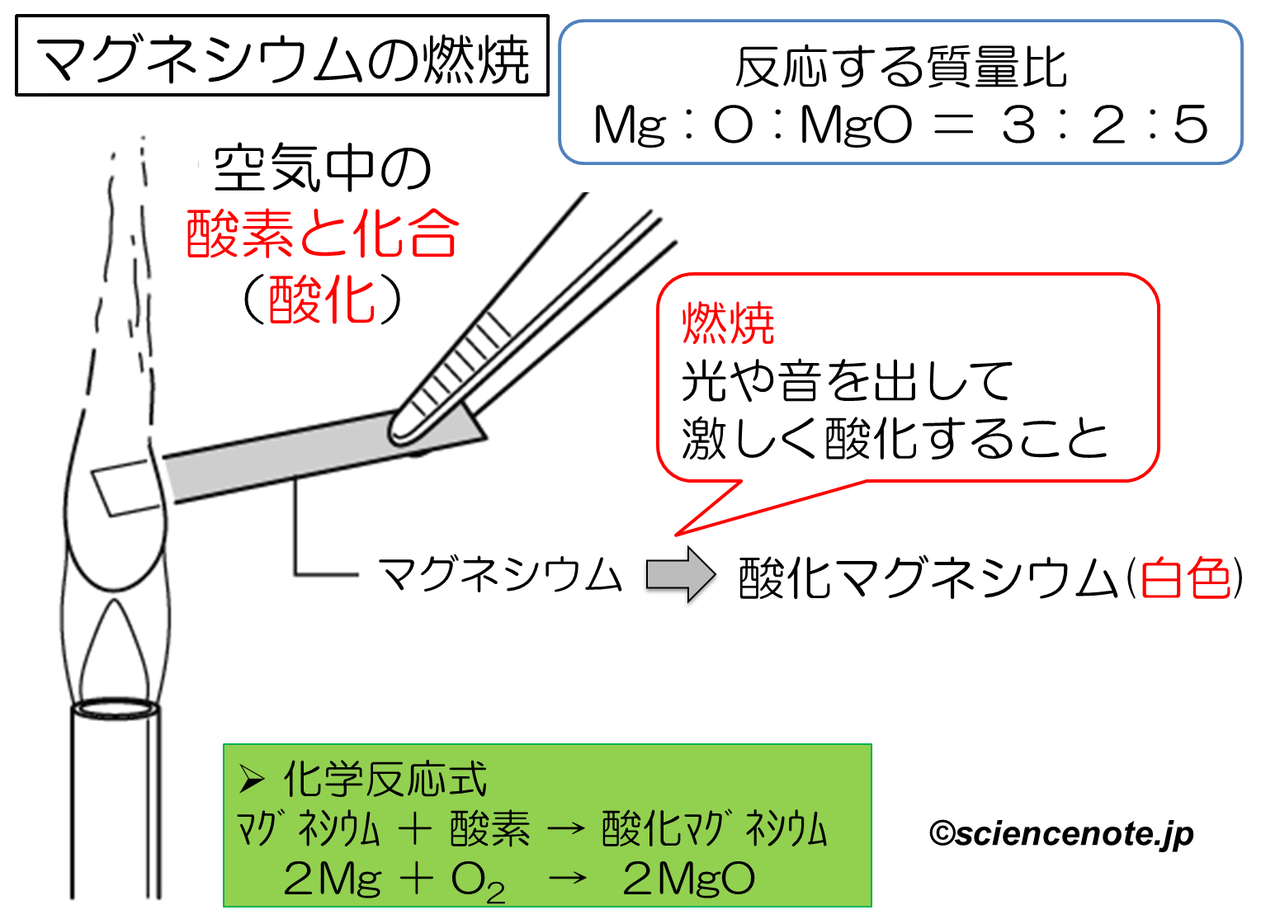



中2化学 マグネシウムの燃焼 Sciencenote Jp




Pdf Electron Microprobe Analysis Of Mg Ge Alloy Examination Of The Mass Absorption Coefficient Of Ge For Mg Ka



Center Esnet Ed Jp Uploads 06kenkyu 03 Kiyou No74 H19 22 02 Pdf



マグネシウムと塩酸を反応させて水素を集める実験についてです 実際に捕集さ Yahoo 知恵袋




19 号 マグネシウム合金を用いた輸送機器の部品 Astamuse




1分野 化学変化 原子分子 K S理科実験室 K S Science Lab




Mg Oh 2 水酸化マグネシウム Kojundoオンライン




マグネシウム Wikipedia




楽天ブックス 理工系のための 化学実験 生物工学実験 東京電機大学 自然科学系列 本




1分野 化学変化 原子分子 K S理科実験室 K S Science Lab




18 号 マグネシウム含有オキシトシン製剤および使用の方法 Astamuse



マグネシウム Wikipedia




元素 Minecraft Wiki




マグネシウムと酸の反応 らくらく理科教室




最新物質 の 質量 の 求め 方 最高のぬりえ
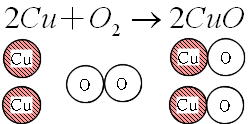



Science 化学変化と質量比 定比例の法則と原子量 分子量 働きアリ



実習11 定比例の法則 2年理科 Takaの授業記録17



何故元素表の水素 ベリリウム マグネシウムの後は空欄が続くのですか Quora
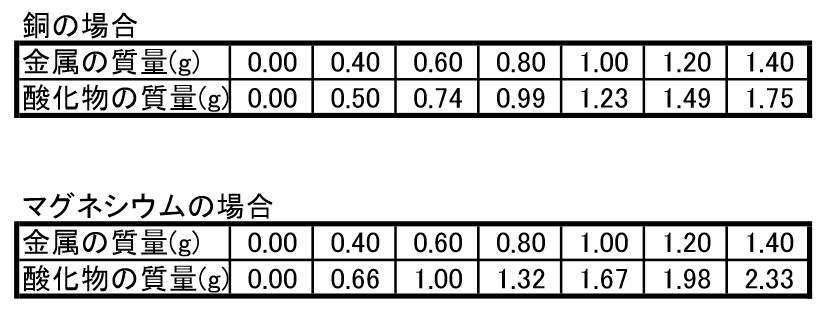



化学変化と物質の質量4 質量変化の規則性 後編 理科とか苦手で




Amazon 元素標本 マグネシウム Mg 10mm角キューブ 刻印aタイプ 岩石 鉱物 おもちゃ




50ml 2mg Lihat Cara Penyelesaian Di Qanda



Q Tbn And9gcqx29l0covdt6jmyppnky Eaexkeg15vuflkcpnlilf3grcg3b8 Usqp Cau




ららマジ 約3年半 ありがとうございました 1 ららマジの話題 6 3 水 16時頃 ツイ速クオリティ Twitter



イオンの問題です なぜマグネシウムは原子を2つ失うのですか 中3でも分 Yahoo 知恵袋



1




実験レポート Mgと塩酸の反応 楽しくチャレンジ



めちゃくちゃ急いでます 中学2年生理科科学の質問です 1枚目 Yahoo 知恵袋




1g 1 80g Descubre Como Resolverlo En Qanda




マグネシウム Magnesium にがりの成分から軽量化合物材料まで Chem Station ケムステ




酸化マグネシウム Wikipedia



マグネシウム Wikiwand




新基礎化学実験法の通販 谷洋介 西井祐二 布谷直義 宮崎裕司 山口和也 山田剛司 吉成信人 紙の本 Honto本の通販ストア



Researchmap Jp Read Published Papers Attachment File Pdf



2




理工系のための化学実験 生物工学実験 東京電機大学自然科学系列 Hmv Books Online



アボガドロ数の測定法




永遠の定番実験 マグネシウムの還元 酸化反応




Pdf Electron Microprobe Analysis Of Mg Ge Alloy Examination Of The Mass Absorption Coefficient Of Ge For Mg Ka




高校化学基礎 過不足の計算1 映像授業のtry It トライイット




問2なんですがどこが間違っているのか分からないので知りたいです Clear




化学の質問です 写真のような条件で実験し 反応物の過不足を考える時 化学 教えて Goo



2



Www Chiba C Ed Jp Shidou K Kenkyu H25 Rika 1 Pdf




永遠の定番実験 マグネシウムの還元 酸化反応




中学2 3年理科の化学計算 ゴロ合わせで化学を楽々制覇 その 原子量 水の電気分解 金属の酸化と燃焼 Studygeek スタディーギーク



Www Nakatani Foundation Jp Wp Content Uploads 16fed80a4e7da8418e94ec923f05b58e Pdf




Pdf Electron Microprobe Analysis Of Mg Ge Alloy Examination Of The Mass Absorption Coefficient Of Ge For Mg Ka




問3の解き方教えて欲しいです 答えは27になるみたいです Clear



Www Pref Chiba Lg Jp Kyouiku Shidou Gakuryoku Documents 04 12 Pdf




Omg マグネシウム Mg 周期表 Zazzle Co Jp



中二化学変化うすい塩酸60 3の中にマグネシウムを入れて発生する気 Yahoo 知恵袋



理工系のための 化学実験 生物工学実験 東京電機大学 自然科学系列 編集 学術図書出版社 版元ドットコム




7 12 6 1 100g I 10g 1 Descubre Como Resolverlo En Qanda



永遠の定番実験 マグネシウムの還元 酸化反応



2



0 件のコメント:
コメントを投稿